Imunizante se mostrou eficaz e seguro contra doença parasitária que ameaça 800 milhões de pessoas em 70 países
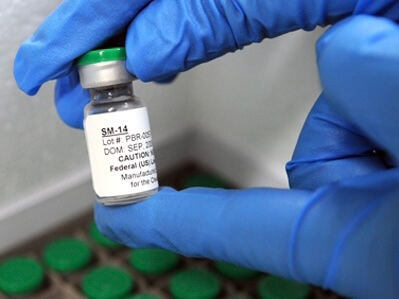
A primeira vacina para esquistossomose acaba de ser aprovada nos testes clínicos de fase 1, mostrando ser segura e capaz de induzir imunidade à doença, que afeta 200 milhões de pessoas no mundo.
Baseada no antígeno Sm14, desenvolvido e patenteado pelo Instituto Oswaldo Cruz (IOC/Fiocruz), a vacina coloca o nome do Brasil na fronteira da ciência mundial, como a primeira vacina para helmintos (vermes). Com um ganho extra: como tem potencial multivalente, a vacina já mostrou ser eficaz para a fasciolose (verminose que afeta o gado) e poderá, potencialmente, ser usada como base para o desenvolvimento de imunizantes para outras doenças humanas causadas por helmintos.
O anúncio foi feito na manhã desta terça-feira (12/06), no campus da Fiocruz, em Manguinhos (RJ), por meio de coletiva de imprensa que contou com a participação da diretora do IOC, Tania Araújo-Jorge; do presidente da Fiocruz, Paulo Gadelha; da pesquisadora responsável, Miriam Tendler e do superintendente de Produtos Biológicos da Ourofino Agronegócios, Carlos Henrique Henrique.
A iniciativa também é um marco para a pesquisa em âmbito nacional, pois esta é a primeira vez em que são realizados no Brasil testes clínicos de fase 1 para uma vacina, uma vez que os testes com pacientes, por regras internacionais, devem obrigatoriamente ser realizados no país de origem da tecnologia. A Sm14 inova, ainda, do ponto de vista do modelo de pesquisa, sendo foco da primeira parceria público-privada desenvolvida pela Fiocruz, estabelecida com a empresa Ourofino Agronegócios, com apoio de agências de financiamento, como a FINEP e a Faperj.
São mais de 30 anos de empenho, liderados pela pesquisadora do IOC Miriam Tendler. “Esta inovação é originalmente brasileira, o que coloca o país na fronteira do conhecimento em uma área de alta complexidade tecnológica, o setor saúde. O projeto é apoiado por uma rede nacional e internacional de instituições colaboradoras, com mecanismos de financiamento oriundos tanto do governo quanto da iniciativa privada”, sintetiza.
A diretora do Instituto, Tania Araújo-Jorge, ressalta a relevância da iniciativa no cenário científico. “Este é um avanço emblemático para a ciência brasileira porque estamos fazendo desenvolvimento científico de ponta: é a primeira vacina para uma doença parasitária no mundo. Isso retrata o compromisso histórico e a capacidade do IOC de trabalhar, desde a pesquisa básica, com olhos focados em mudar uma realidade de saúde de alto impacto no país”, avalia.
O presidente da Fiocruz, Paulo Gadelha, afirma que a conquista reflete mudanças no país, no sentido de reforço à pesquisa nacional, como os mecanismos de fomento e a forma como as parcerias são realizadas. “A Fiocruz se orgulha de, mais uma vez, fazer história na ciência”, ressalta.
Assim como em outras vacinas, o imunizante nacional foi produzido a partir de um antígeno – substância que estimula a produção de anticorpos – para preparar o sistema imunológico do ser humano à infecção pelo parasito, impedindo que ele se instale no organismo ou que lhe cause danos. Neste caso, é utilizada a proteína Sm14, obtida do Schistosoma mansoni, verme causador da doença na América Latina e na África.
A proteína-base da vacina, isolada e caracterizada no Laboratório de Esquistossomose Experimental do IOC, na década de 90, foi escolhida pela Organização Mundial da Saúde (OMS) como um dos seis antígenos mais promissores no combate à doença. Destes seis antígenos, apenas dois (um deles é a Sm14) seguem o caminho difícil que leva da bancada do laboratório ao produto.
A proteína foi construída como proteína recombinante e escalonada (teve sua capacidade de produção em volume industrial comprovada), chegando-se à produção do chamado lote semente da vacina para testes clínicos, aprovado pela Agência Nacional de Vigilância Sanitária (ANVISA).
O projeto, que acaba de ter finalizada a etapa de testes clínicos de fase 1, em voluntários humanos, obteve resultados que garantem que a vacina é segura para uso humano e que é imunogênica, sendo capaz de produzir proteção para a doença.
O Teste Clínico Fase 1 em humanos teve início em maio de 2011, logo após a aprovação do protocolo clínico de pesquisa pela Anvisa e foi conduzido pela equipe do Instituto de Pesquisa Evandro Chagas (Ipec/Fiocruz).
Desde o início, a pesquisa foi apoiada financeiramente pelo IOC e pelos mecanismos de financiamento de pesquisas científicas como CNPq e FINEP, entre outros. Sua primeira fase de desenvolvimento tecnológico foi apoiada pelo Programa de Desenvolvimento Tecnológico em Insumos para Saúde (PDTIS/Fiocruz). Em 2005, a empresa Alvos licenciou a vacina veterinária e a vacina humana mediante estabelecimento de parceria público-privada.
A empresa foi adquirida pela Ourofino Agronegócios Ltda, que assumiu toda a parte industrial do processo. “Viabilizar este projeto é um compromisso da Ourofino Agronegócios. As vacinas usadas no Brasil tendem a ser produzidas por empresas multinacionais. Esta é a oportunidade de nosso País mostrar para o mundo o potencial científico e tecnológico que possuímos”, comenta o superintendente de Biológicos da empresa, Carlos Henrique Henrique.
Agora, com a vacina humana comprovadamente segura, o objetivo maior tanto do Instituto Oswaldo Cruz quanto da Ourofino é transformar a vacina humana em vacina humanitária, garantindo seu acesso às populações de áreas endêmicas em todo o mundo, majoritariamente pobres.
Famílias de patentes da molécula Sm14
A molécula Sm14 está protegida pelas famílias de patentes BRPI110551-3, BRPI0308978-9, BRPI0303266-3, BRPI0900896-9, BRPI005855-9 e correspondentes na Europa, Estados Unidos, Austrália, Japão, Nova Zelândia, África do Sul, Canadá, Cuba, Egito, Índia, ARIPO e OAPI.
Fonte: Instituto Oswaldo Cruz